Perbedaan Ikatan Kovalen Polar dan Non Polar - Hallo sahabat Blog Tiga Putra, Pada Artikel kali ini yang berjudul Perbedaan Ikatan Kovalen Polar dan Non Polar, kami berusaha mempersiapkan artikel ini dengan sebaik baiknya untuk anda baca dan ambil informasi didalamnya. Semoga isi postingan Artikel catatan, yang kami tulis ini dapat dengan mudah anda pahami. baiklah, selamat membaca.
Judul : Perbedaan Ikatan Kovalen Polar dan Non Polar
link : Perbedaan Ikatan Kovalen Polar dan Non Polar
Perbedaan Ikatan Kovalen Polar dan Non Polar
Ikatan kimia yang terjadi karena adanya penggunaan pasangan elektron secara bersama-sama oleh atom yang berikatan disebut Ikatan Kovalen . Hal ini berarti, pasangan elektron ini digunakan secara bersama-sama (shared electron / elektron sekutu). Sebagai contoh sederhana adalah terjadinya ikatan kovalen yang terjadi antara unsur hidrogen dengan oksigen membentuk molekul air (H2O). Masing-masing ikatan kovalen mengandung dua elektron, yaitu berasal dari oksigen dan satunya lagi berasal dari hidrogen.
Jenis-jenis Ikatan Kovalen
Ada dua macam ikatan kovalen, antara lain ikatan kovalen non polar dan Ikatan kovalen polar . Perbedaan di antara keduanya adalah asal pemakaian elektron yang digunakan untuk berikatan. Berikut adalah perbedaan ikatan kovalen polar dan nonpolar.
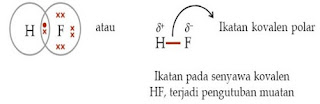
1. Ikatan Kovalen Polar
Ikatan kovalen polar adalah ikatan kovalen yang terbentuk ketika elektron sekutu di antara atom tidak benar-benar dipakai secara bersama-sama. Hal ini terjadi apabila satu atom mempunyai elektronegativitas yang lebih tinggi daripada atom yang lainnya. Atom yang mempunyai elektronegativitas yang tinggi akan mempunyai tarikan elektron yang lebih kuat. Hal ini menyebabkan elektron sekutu akan lebih dekat ke atom yang memiliki elektronegativitas tinggi.
Dengan kata lain, akan menjauhi atom yang mempunyai elektronegativitas rendah. Ikatan kovalen polar membuat molekul yang terbentuk mempunyai potensial elektrostatis. Potensial ini akan menyebabkan molekul menjadi lebih polar, karena ikatan yang terbentuk dengan molekul polar lain relatif lemah.
Berikut ini adalah contoh dari senyawa kovalen polar adalah NH3,PCl3, H2O, dan Cl2O.
2. Ikatan Kovalen Non Polar
Ikatan kovalen yang terbentuk ketika atom membagikan elektronnya secara setara (sama). Hal ini terjadi apabila ada atom mempunyai afinitas elektron yang sama atau hampir sama Ikatan adalah kovalen nonpolar . Bila nilai afinitas elektron Semakin dekat , maka ikatannya semakin kuat.
Ikatan kovalen nonpolar terjadi pada molekul diatomik molekul gas, atau yang sering disebut sebagai. Ikatan kovalen nonpolar mempunyai prinsip kerja yang sama dengan ikatan kovalen polar, yaitu atom yang mempunyai nilai elekronegativitas tinggi akan menarik elektron lebih kuat. Pernyataan tesebut benar, namun jika terjadi pada molekul diatom (dimana atom penyusunnya adalah sama) maka elektronegativitas juga sama.
Contohnya pada Iodine (I). Dalam pembentukan molekul I2, dalam ikatan kovalen kedua elektron digunakan secara seimbang oleh kedua core atom iodin tersebut. Oleh karena itu, muatan ( tidak terjadi pengutuban atau polarisasi muatan ) tidak akan terbentuk. Contoh senyawa lain yang memiliki bentuk molekul simetris dan bersifat nonpolar adalah CH4, BH3, BCl3, PCl5, dan CO2.
Ciri-ciri senyawa polar
1. Dapat larut dalam air dan pelarut lain
2. Memiliki kutub positif (+) dan kutub negatif (-), akibat tidak meratanya distribusi elektron
3. Memiliki pasangan elektron bebas ( bila diketahui bentuk molekulnya ) atau molekul memiliki perbedaan keelektronegatifan.
Contoh : alkohol, HCl, PCl3, H2O, N2O5.
Ciri-ciri senyawa non polar
1. Tidak larut didalam H2O ( air ) atau pelarut polar lain
2. Tidak memiliki kutub positif (+) dan kutub negatif (–), akibat meratanya distribusi elektron
3. Tidak memiliki PEB ( bila bentuk molekul diketahui ) atau ke elektronegatifannya sama.
Contoh : Cl2, PCl5, H2, N2
Untuk lebih jelasnya silahkan nonton video dibawah ini




Tidak ada komentar:
Posting Komentar